Physik der Anlagenmechanik
Begriffe und Definitionen aus der Wärmelehre
Wärme:
Unter Wärme versteht man die Energieform die sich aus der
Eigenbewegung der Atome und Moleküle ergibt. Bei festen Stoffen ist
die Energieform als Schwingungs- oder Rotationsenergie vorhanden,
bei Gasen und Flüssigkeiten ist die Bewegung frei. Für die Wärme ist
als Einheit das Joule (J) festgelegt. Das entspricht der Leistung
von 1 Watt (W), die in der Zeit von einer Sekunde (s) wirkt. (1J=1W
• s). Die Wärme strömt immer von einem höheren zu einem niedrigen
Temperaturbereich.
Wärmeübertragung:
Die Wärmeübertragung kann in Form von Wärmeleitung in festen,
flüssigen und gasförmigen Stoffen erfolgen.
Die Wärmeübertragung kann in Form von Wärmekonvektion
(Wärmeströmung) in flüssigen und gasförmigen Stoffen erfolgen.
Die Wärmeübertragung kann in Form von Wärmestrahlung in
transparenten Stoffen und im Vakuum erfolgen.
Wärmeleitung:
Unter Wärmeleitung versteht die Übertragung von Bewegungsenergie
zwischen Stoffteilchen von Molekül zu Molekül.
Wärmekonvektion:
Die Wärmekonvektion ist der Wärmetransport durch Strömung von
Flüssigkeiten und Gasen. Konvektion bedeutet so viel wie mitführen.
Wärmestrahlung:
Die Übertragung von Wärmeenergie durch elektromagnetische Wellen
zwischen Körpern unterschiedlicher Temperatur die sich nicht
berühren. Als Beispiel sei die Wärmestrahlung im Weltraum von der
Sonne auf die Erde genannt. Die Strahlung ist an kein Medium
gebunden.
Wärmeleitfähigkeit:
Die Eigenschaft von Stoffen Wärme zu leiten bezeichnet man als
Wärmeleitfähigkeit. Die stoffspezifische Größe wird nach genormten
Messverfahren ermittelt. Dabei wird die Wärmemenge in Joule bzw. in
Wattsekunden (Ws) gemessen, die in einer Sekunde durch ein
Quadratmeter einer ein Meter dicken homogenen Stoffdicke senkrecht
zu den Oberflächen fließt, wenn der Temperaturunterschied 1 Kelvin
beträgt. Der Rechenwert für die Wärmeleitfähigkeit ist ? (Lamda) in
W / (m•K).
Wärmetechnik,Wärmeleiter Wärmeübertragung durch Konvektion
Wenn im Winter ein Zimmer längere Zeit nicht beheizt wurde, empfinden wir die Temperatur in diesem Zimmer als kühl, obwohl die Lufttemperatur wieder auf 20°C angestiegen ist. Ob uns Menschen ein Raum warm erscheint, hängt nicht nur von der Lufttemperatur, sondern auch von der Wandtemperatur ab. Sind die Wände durch schlechte Dämmung oder unregelmäßiger Heizung zu kalt, so strahlt der menschliche Körper trotz ausreichend warmer Luft mehr Wärme ab, als er empfängt. In diesem Zustand frösteln wir. Anderseits kann man bei niedriger Lufttemperatur behaglich im Freien sitzen, wenn die Wärmestrahlung der Sonne ausreicht. Auch die wegen der CO2 Abgabe ins Gerede gekommenen Heizstrahler, wie man sie heutzutage in Biergärten von zahlreichen Gasstätten findet, erfüllen die gleiche Aufgabe, wenn die Strahler stark genug sind.
Auch bei einer Glühlampe mit einer Doppelwendel wird dieser Effekt genutzt. Die einzelnen Windungen der Wendeln strahlen sich gegenseitig Wärme zu. Dadurch entsteht eine höhere Temperatur und somit steigt ebenfalls die Lichtausbeute, obwohl gegenüber einer Glühbirne mit einem einfachen Glühdraht, obwohl die gleiche elektrische Energie benötigt wird.
Die verschiedenen Formen der Wärmeübertragung kommen in unterschiedlichen Kombinationen vor. In einem Heizkessel wird die Wärme die aus den Verbrennungsgasen entsteht der Kesselwand zugestrahlt, durch die Metallwand transportiert und dadurch das Wasser im Kessel beheizt. Durch Konvektion oder Wärmemitführung mit dem Heizwasser wird die thermische Energie zum Heizkörper transportiert. Der erwärmte Heizkörper gibt einen Teil seiner Wärme durch Direktstrahlung an den zu erwärmenden Körper wie z.B. Möbel. Ein anderer Teil wird an die Raumluft abgegeben und durch Luftströmung wird die Wärme im Raum verteilt. Bei einer Ofenheizung gibt es ebenfalls den kombinierten Wärmetransport.
In der Wärmetechnik ist es von besonderer Bedeutung wo sich die Wärmequelle im Raum befindet. Ist der Heizkörper unter dem Fenster montiert, steigt die erwärmte Luft nach oben. Kühlere Luft strömt über dem Fußboden dem Heizkörper entgegen. Steht ein Ofen vom Fenster entfernt, so steigt die erwärmte Luft ebenfalls auf. Die nachströmende Luft kommt vom kalten Fenster her, und wird als unangenehm kalt empfunden.
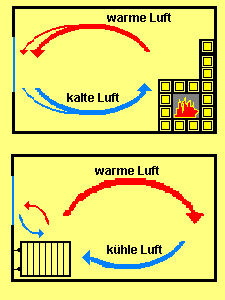
Will man den Wärmetransport durch Konvektion verhindern, müssen die zugehörigen thermischen Transporte unterbrochen werden. Durch Styropor oder Schaumstoffen wird die erwärmte Luft in kleinen Poren eingeschlossen. Mit solchen Stoffen umhüllt man Heizungsrohre, um Wärmetransporte durch Konvektion zu vermeiden. Das gleiche gilt für Kleidung. Die Wärmeübertragung durch Konvektion ist an den Transport von Materie gebunden, wie in unserem Fall transportiert das Heizwasser die Wärme. Bei der Konvektion werden die Moleküle zusammen mit ihrer Bewegungsenergie transportiert.
Dagegen sind bei der Wärmeleitung die Moleküle ortsfest und geben Schwingungsenergie durch eine Vielzahl von Stößen von Molekül zu Molekül weiter. Die Moleküle wandern dabei selbst nicht mit. Verschiedene Metalle wie Kupfer, Aluminium und Eisen leiten die Wärme gut. Glas, Holz und Kunststoffe sind schlechte Wärmeleiter. Handgriffe bei Armaturen bestehen daher aus Kunststoffen.
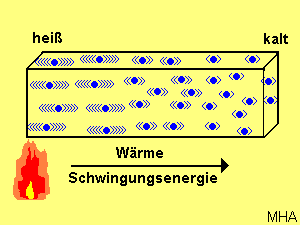
Häufig treten Wärmeleitung und Konvektion gemeinsam auf. Strömt die Luft an einer festen Wand entlang, ist die Strömungsgeschwindigkeit unmittelbar an der Wand sehr klein. In dieser Grenzschicht findet kaum eine Wärmemitführung oder Konvektion statt. Der Transport der Wärme ist stark behindert. Bei Isolierstoffen wirkt das vorteilhaft. Bei Erhöhung der Strömungsgeschwindigkeit wird die Grenzschicht dünner und somit der Wärmetransport erhöht. Dieser physikalische Effekt kommt einem Autokühler zugute.
Wärmelehre, Thermodynamik - Der Wärmezustand der Körper
In der Mechanik werden die Grundgrößen Länge, Masse und Zeit verwendet. In der Wärmelehre (Thermodynamik) tritt eine vierte Größe auf, nämlich die Temperatur. Für die Festlegung der Temperaturskala nimmt man die Wärmeausdehnung des Quecksilbers. Durch Eintauchen eines Thermometers in schmelzendes Eis und siedendes Wasser ergeben sich zwei Eckpunkte, nämlich 0° Celsius und 100° Celsius. Teilt man diese Eckpunkte in 100 gleiche Teile ein, ergibt das die geläufige Celsiusskala, welche 1742 durch den schwedischen Astronomen Anders Celsius eingeführt wurde. Die Skala kann an den oberen Punkt und am unteren Punkt fortgesetzt werden, ist jedoch vom Gefrierpunkt des Quecksilbers -38,8°C und vom Siedepunkt +357° Celsius begrenzt. Das ganze gilt bei einem Luftdruck von 101333 Pa (Pascal) oder 1013,33 hPa (Hektopascal).
Mit dem gleichem Zahlenwert kann er auch in Millibar (mbar) angegeben werden. 1 hPa = 1 mbar = 0,75 Torr . 1013,33 hPa sind gleich 760 Torr. Die Maßeinheit Torr (gleich mm HG oder mm Quecksilbersäule) wurde vor 1978 in Deutschland für den Druck verwendet. Ein Torr ist der statische Druck, der von einer Quecksilbersäule von 1 mm Höhe erzeugt wird. Seit 1978 gilt das internationale Einheitensystem SI (aus der französischen Sprache: Système international d'unités ) und wird in der Europäischen Union und anderen Staaten verwendet. Die Einheiten Torr und Atmosphäre für den Luftdruck werden nicht mehr verwendet.
Feste Körper dehnen sich bei erhöhter Temperatur in allen drei Dimensionen aus, das Volumen des Körpers steigt. Bei langen Stäben kann man in der Wärmelehre vor allem eine Längenzunahme beobachten. Fast alle Metalle dehnen sich zwischen 0°C und 100°C gleichmäßig aus.
Flüssigkeiten dehnen sich bei gleicher Temperaturerhöhung wesentlich stärker aus, die Ausdehnung ist ungleichmäßiger als z.B. beim Quecksilber. Die Ausdehnungskoeffizienten von flüssigen und festen Körpern hängen vom Stoff ab.
Beim Gas hängt das Volumen vom Druck und der Temperatur ab. Aus Versuchsreihen wurden bereits im siebzehnten Jahrhundert von den Physikern Boyle und Mariotte unabhängig entdeckt: Druck und Volumen einer abgeschlossenen Gasmenge sind bei konstanter Temperatur umgekehrt proportional. Es gilt p x V = konstant. P für Druck und V für Volumen . Dieses Gesetz von Boyle und Mariotte gilt umso genauer, je kleiner der Druck ist, und je weiter man vom Verflüssigungspunkt des Gases entfernt ist.
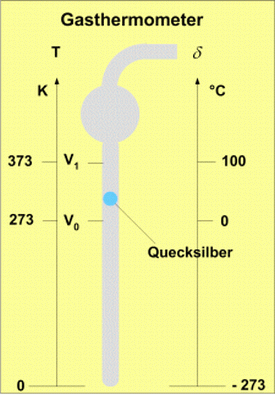
In der Wärmelehre oder Thermodynamik findet man den Zusammenhang zwischen Volumen und der Temperatur der Luft mit Hilfe eines einfachen Gasthermometers. Dieses Thermometer besteht aus einer 30cm langen Kapillare von 1mm2 Innenquerschnitt, die oben in eine kugelförmige Erweiterung und danach in ein anschließendes weiteres Rohr übergeht. Die Kapillare wird schräg gestellt und in die obere Kugel wird ein Tropfen Quecksilber eingebracht. Die Öffnung des Proberöhrchens wird im schrägen Zustand in ein weiteres Glasröhrchen mit einem scharfen Trockenmittel gesteckt, damit der Wasserdampf, welcher die Versuchsergebnisse verfälscht, entweicht. Nach einigen Tagen saugt man mit einer Glasspritze etwas Luft aus der Kapillare. Nun drückt der äußere Luftdruck den Quecksilbertropfen in die Kapillare hinein. In der senkrecht gestellten Kapillare bleibt der Druck der eingeschlossenen Luft konstant.
Beim ersten Versuch stecken wir die Kapillare in schmelzendes Eis, und die eingeschlossene Luft zieht sich zusammen. Auf dem Glasröhrchen wird das Volumen bei 0°Celsius markiert. Ebenso markieren wird die Kapillare bei 100°C heißem Wasserdampf. Man erkennt durch Augenschein eine nicht ganz dreifache Volumenzunahme bei diesem Versuch. Wenn man die Versuche mit Wasserstoff, Sauerstoff und anderen Gasen wiederholt, bekommt man das gleiche Ergebnis. Es ergibt sich das Gesetz in der Wärmelehre von Gay-Lussac welches besagt:
Alle Gase dehnen sich beim Erwärmen von 0°C auf 100°C um den 2,73ten Teil ihres Volumen bei 0°C aus, wenn Druck und Gasmenge konstant sind.
Auch dieses Gesetz sowie das Gesetz von Boyle und Mariotte, ist in der Wärmelehre ein Näherungsgesetz. Ein Gas, das beiden Gesetzen gehorcht und beim Abkühlen nicht flüssig wird, wird als ein ideales Gas bezeichnet. Wasserstoff und Helium kommen bei niedrigem Druck dem idealen Gaszustand sehr nahe.
Während sich die einzelnen Flüssigkeiten verschieden stark und ungleichmäßig ausdehnen, zeigen Gase ein einfaches von ihrer chemischen Beschaffenheit unabhängiges Verhalten. Deshalb kann man mit ihrer Hilfe eine Temperaturskala festlegen, indem man das Volumen des Gasthermometers zwischen V0 und V100 in gleiche Teile aufteilt. Auf jeden so festgelegten Gradschritt dehnt sich das Gas bei Erwärmung um 1 Grad um den 273.sten Teil seines Volumen aus, sofern der Druck konstant bleibt. (Gesetz von Gay-Lussac)
Beim Gas nimmt das Volumen weiter ab, wenn man es unter 0° Celsius abkühlt. So kann man mit dem Gasthermometer auch Temperaturen unter 0°C messen. Die Teilung auf der Kapillare wird in gleicher Weise nach unten fortgesetzt, und mit negativen Werten versehen. Das untere Ende der Kapillare wird mit minus 273°C bezeichnet. Dies stimmt mit dem Gesetz von Gay-Lussac überein, und gäbe es ein Gas das dieses Gesetz befolgt, so wäre bei -273°C sein Volumen null. Eine Abkühlung unter -273°C ist nicht möglich, daher ist diese Temperatur der absolute Nullpunkt. Bei dieser Temperatur gibt es in einem Stoff keine Bewegung der Atome. Wird von diesem Bezugspunkt gemessen, vermeidet man negative Werte und erhält die sog. absolute Temperatur 0° K (Kelvin). Seit 1967 heißt es nur noch 0 K. Das K (Kelvin) ist nach dem englischen Physiker William Thomson, dem späteren Lord Kelvin benannt. Dieser Physiker führte im jungen Alter von 24 Jahren die thermodynamische Temperaturskala ein. Diese fängt bei null Kelvin an und hat die gleiche Gradierung wie die Celsiusskala. Der Gefrierpunkt des Wassers liegt somit bei 273 K. Das Kelvin wird in der Wärmelehre bei Temperaturdifferenzen verwendet.
Ein Quecksilberthermometer liefert im Rahmen bestimmter Messgenauigkeiten im normalen Temperaturbereich gleiche Werte gegenüber von Gasen. Oberhalb von 200°C in der Nähe des Siedepunktes von Quecksilber treten jedoch bei Messungen erhebliche Unterschiede in der Ausdehnung auf.
Ein Gasthermometer hat den Nachteil, dass sich der Anfangsdruck durch tägliche Luftdruckänderungen bei verschiedenen Wetterlagen abweicht, und somit in der praktischen Wärmelehre nicht geeignet ist.
Wärme und Arbeit - Das mechanische Wärmeäquivalent - Perpetuum Mobile
Um die Temperatur eines Körper zu erhöhen, muss man ihm eine gewisse Wärmemenge zuführen. Die erforderliche Wärmemenge Q ist proportional zur Masse m des Körpers und zur Temperaturdifferenz Delta t (?t Endtemperatur minus Anfangstemperatur) und der Proportionalitätsfaktor c der für jeden Stoff einen eigenen Wert besitzt. Es gilt : Q = c × m × ?t. Die Einheit der Wärmemenge ist zunächst noch willkürlich, und für eine bestimmte Substanz läßt sich c* so wählen, dass der Zahlenwert 1 ist.
Man verwendet Wasser und legt fest:
1 Kilokalorie (kcal) ist diejenige Wärmemenge, die 1 kg Wasser um 1
Grad erwärmt. (1 kcal = 1000 cal).
Oder moderner und besser nach SI (Système international d'unités): 4,2 Joule erwärmen 1cm3 Wasser um 1 Kelvin, alles bei einem normalen atmosphärischen Luftdruck von 1013,25 Hektopascal hPa.
Die Einheit Kalorie (cal) (das Wort kommt aus dem Lateinischen Calor = Wärme) für die Wärmemenge ist veraltet. Heute ist die Einheit für die Wärmemenge die SI-Einheit Joule (J). Eine Kalorie entspricht ungefähr 4,186 Joule. Die Einheit Kalorie findet man jedoch noch für die Bezeichnung von Brennwerten auf Lebensmittelverpackungen. Offensichtlich kann mit der Einheit Joule noch keiner sich was Richtiges vorstellen, jedoch als Umrechnungsfaktor in andere Energieformen ist die Einheit Joule besser geeignet. Ab dem Jahr 2010 soll in der Europäischen Union nur noch die SI-Einheit Joule verwendet werden. Die SI-Einheit Joule für Energie, Arbeit und Wärmemenge ist zu Ehren des englischen Physikers James Prescott Joule (1818-1889) benannt.
1 Joule (J) ist gleich 1 Newtonmeter ( 1N×1m) , oder 1 Wattsekunde. (1W×1s)
Der Faktor c* heißt spezifische Wärme und hat die Einheit kJ /Kelvin × Kg. Eine von vielen physikalischen Eigenschaften eines Stoffes ist seine spezifische Wärme. Die spezifische Wärme ist die Energie die man einer bestimmten Masse eines Stoffes zuführen muss, um seine Temperatur um 1 Kelvin zu erhöhen.
Die Messung der Wärmemenge wird mit einem Kalorimeter durchgeführt.
Bei den Gasen stellen sich verschiedene Werte der spezifischen Wärme ein, je nachdem, ob man den Druck p oder das Volumen V konstant hält. Wird das Gas in einem abgeschlossenen Raum erwärmt, so steigt der Druck. Bei konstantem Volumen Cv erhält man die spezifische Wärme. Erwärmt man das Gas bei konstantem Druck, so nimmt das Volumen des Gases zu, und man erhält die spezifische Wärme bei konstantem Druck Cp. Durch physikalische Experimente wurde ermittelt: Cp > Cv.
In der Wärmelehre oder Thermodynamik wird die Wärmeenergie als eine Form der Änderung der inneren Energie bezeichnet. Die Wärmeenergie kann durch Wärmeübertragung auf die Umgebung eines Körpers übertragen werden, oder ist auch zur Verrichtung von mechanischer Arbeit zu gebrauchen. Dabei geht der Energiefluss immer vom wärmeren zum kälteren Medium. Geht Wasser von 100°C in Dampf von 100°C über, muss Wärme zugeführt werden. Umgekehrt wird Wärme freigesetzt, wenn aus Wasserdampf wieder flüssiges Wasser wird. Bei der Wärmepumpe wird dieser physikalische Vorgang genutzt.
Bei allen Reibungsvorgängen erhöht sich die Temperatur. Fährt man irrtümlich mit einem Auto mit angezogener Handbremse, so werden nach kurzer Zeit die hinteren Felgen heiß, weil sich dorthin die Reibungswärme der Bremstrommel überträgt. Die beim Reiben entstehende Wärmemenge ist der Reibungsarbeit proportional. Wärmeenergie und mechanische Energie können wechselseitig umgewandelt werden. Die innere Energie eines Systems nimmt zu, wenn man an ihm Arbeit verrichtet oder ihm Wärme zuführt. Arbeit und Wärmemenge sind einander nach der folgenden Beziehung äquivalent: 1 kcal gleich 427 kpm und umgekehrt, also haben gleiche Werte.(mechanisches Wärmeäquivalent) Dieser erste Hauptsatz der Wärmelehre läßt sich auf die geniale Entdeckung des Heilbronner Arztes Julius Robert Mayer(1814-1878) zurückführen.

Mayer war der Vorreiter des Prinzips von der Erhaltung der Energie. Der Universalgelehrte Hermann von Helmholtz (1821-1894) sprach den Energiesatz in der folgenden, alle Energiearten umfassenden Form detaillierter als Mayer aus:
In einem abgeschlossenen System, also ein System, dem von außen Energie weder zugeführt noch entzogen wird, ist die innere Energie unveränderlich.
Seine Richtigkeit wird durch die vielen Bemühungen unzähliger Erfinder bestätigt, ein Perpetuum Mobile zu bauen. (lateinisch: perpetuus andauernd; mobilis beweglich). Es handelt sich um eine Maschine, die nicht nur in ständiger Bewegung bleibt, sondern darüber hinaus mehr Energie abgibt als sie aufnimmt.
Eine knappe Form des Energiesatzes lautet: Ein Perpetuum Mobile ist unmöglich.
Dieser Satz von der Erhaltung der Energie wurde an den verschiedenartigsten Experimenten geprüft und immer wieder bestätigt. Durch seine umfassende Geltung geht seine Bedeutung weit über anderen physikalischen Sätzen hinaus. Die gesammte Natur wird vom Prinzip von der Erhaltung der Energie beherrscht.
Kältemaschine Luftverflüssigungsverfahren flüssige Luft - Luftverflüssigung
Jeder der ein Fahrrad besitzt hat vielleicht schon folgende Beobachtungen gemacht. Wenn beim Aufpumpen eines Fahrradschlauches durch eine Fahrradpumpe Luft verdichtet wird erwärmt sie sich. Umgekehrt kühlt sich die Luft ab, wenn sie aus dem Schlauchventil entströmt. Auch bei einer Sprühdose kann man diesen Effekt beobachten, je länger man sprüht, desto kälter wird die Dose. Diese Erscheinung ist sehr bedeutend in der Meteorologie, in der Kältetechnik, bei einer Kältemaschine und somit auch für die Technik der Wärmepumpe.
Im neunzehnten Jahrhundert wurden von den Wissenschaftlern Joule und Thomson sehr genaue Versuche über diese Erscheinung durchgeführt. 1852 zeigten die beiden Forscher, dass ein Gas, welches sich ungestört ausdehnen kann, abkühlt. Dieser Effekt lässt sich dadurch erklären, dass bei allen realen Gasen bei tiefen Temperaturen und hohem Druck Anziehungskräfte zwischen den Molekülen bestehen. Die beim Entspannen des Gases beobachtete Abkühlung ist eine Folge der Arbeit, die gegen diese gegenseitige Anziehung verrichtet werden muss. Die Abkühlung wird umso größer, je mehr ein Gas vom idealen Gaszustand abweicht. Für ein ideales Gas nimmt man an, dass zwischen den Gasmolekülen keine Kräfte wirken, ausgenommen bei Stößen. Reale Gase verhalten sich bei genügend hohen Temperaturen und genügend geringen Dichten ähnlich wie ideale Gase. Die Abweichung sind umso geringer je höher die Temperatur und je höher der Druck ist.
Die Beschreibung realer Gase findet man in der Van- der-Waals-Gleichung , benannt nach dem niederländischen Physiker Johannes Diderik van der Waals. Dieser Physiker erforschte das Verhalten von Molekülen und entdeckte die Wechselwirkung von Kräften zwischen den Molekühlen. Im Jahre 1910 erhielt er für seine Arbeiten den Nobelpreis für Physik.
Auf dem Joule-Thomson-Effekt baute Carl von Linde im Jahre 1895 sein Luftverflüssigungsverfahren auf. Linde verdichtete mit einem Kompressor Luft auf 200bar. Nachdem die dabei entstehende Wärme durch Kompression abgekühlt war, ließ er Luft durch Ausströmen aus einem Ventil entspannen. Die Luft kühlte sich dabei um ca. 40°Kelvin auf minus 25°Celsius ab. Die entspannte und abgekühlte Luft strömte dann der nachfolgenden komprimierten Luft entgegen. Man spricht vom Lindeschen Gegenstromverfahren, wobei die nachfolgende Luft bereits vor ihrer Entspannung vorgekühlt wurde. Auf diese Weise gelangte Linde zu einer Temperatur von -200°C. Bei diesen Temperaturen sind Sauerstoff und Stickstoff schon beim normalen Druck flüssig. Der Begriff Flüssige Luft war somit entstanden.
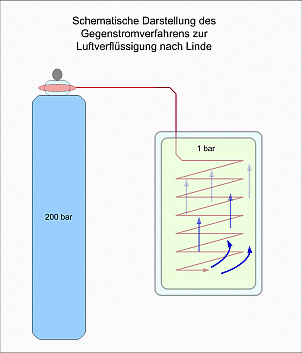
Durch Verwendung einer Sauerstoffflasche kann man den ersten Teil des Lindeschen Verfahrens (Kompression und Wärmeableitung) vorwegnehmen. In einem Thermosgefäß lässt man den vorgekühlten Sauerstoff durch eine mehrlagige Kupferspirale durchströmen. Am Boden des Gefäßes befindet sich das Ende der Spirale, und durch eine sehr feine öffnung kann der Sauerstoff ausströmen. Mittels Vorkühlen durch flüssige Luft und dem Lindeschen Gegenstromverfahren wurde bereits 1908 durch den Niederländer Kamerlingh Onnes Helium bei 4° Kelvin als letztes Gas verflüssigt.
Bei einer Kältemaschine (Kühlschrank) wird in einem Kompressor das Kältemittel im ersten Takt verdichtet und durch ein Ventil in den Kühler geleitet. Kältemittel sind Arbeitsstoffe die durch Verdampfen bei niedriger Temperatur und niedrigen Druck Wärme aufnehmen. Umgekehrt geben sie bei höherem Druck und höherer Temperatur Wärme ab.
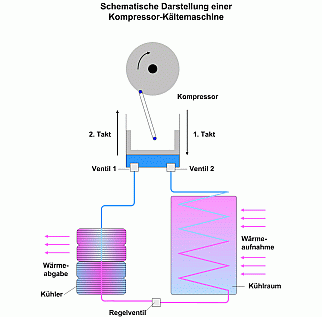
Im Kühler wird die durch die Verdichtung entstandene Wärme an die Außenluft abgegeben. Das auf Zimmertemperatur abgekühlte Kältemittel wird flüssig und anschließend durch ein Regelventil entspannt. Es gelangt in einen Wärmeaustausche, verdampft und entzieht dem Wärmeaustauscher die dafür erforderliche Verdampfungswärme. Von da aus gelangt es durch ein zweites Ventil wieder in den Kompressor.
Verlegt man den Kühler in ein Zimmer, und den Wärmeaustauscher ins Freie, so läst sich die Kältemaschine als Raumheizung verwenden. Die zum Verdampfen erforderliche Wärme wird der Außenluft entzogen, während die Kompressionswärme an die Luft im Zimmer abgegeben wird. Aus der Kältemaschine wird eine Wärmepumpe, welche Wärme von draußen ins Haus pumpt. Die Technik der Wärmepumpe ist also schon lange bekannt. Früher waren jedoch die Preise für fossile Brennstoffe im Vergleich zu heute niedrig und sie wurden ohne Bedenken verbrannt. Daher konnte sich in früheren Zeiten die Wärmepumpe aus Kostengründen am Markt noch nicht durchsetzen.
Grundlagen der Strömungslehre
Bei vielen Heizungsanlagen älterer Bauart kommen bei den Verrohrungen höchst unterschiedliche Rohrquerschnitte vor. Bei den alten offenen Schwerkraftheizungen wurden Rohrleitungen aus Eisen mit einem großen Durchmesser verwendet. Wird an eine solche Anlage ein moderner Wärmeerzeuger wie zum Beispiel die Wärmepumpe angeschlossen, werden dabei meistens Kupferrohre mit einem wesentlich geringeren Durchmesser montiert. In den meisten Fällen werden die alten Rohre weiter verwendet, da ein kompletter Austausch im Haus ein kostspieliges Unternehmen ist. Außerdem entsteht bei solchen Arbeiten viel Schmutz. Das dabei Rohre mit unterschiedlichen Durchmessern verwendet werden, ist eine Beschäftigung mit den Grundlagen der Strömungslehre in diesen Rohren durchaus hilfreich.
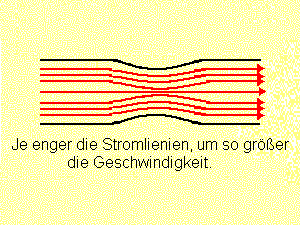
Flüssigkeiten und Gase, auch Fluide genannt, lassen sich leicht gegeneinander verschieben, und haben bei einer Strömung weder eine einheitliche Richtung noch den gleichen Betrag der Geschwindigkeit. Anhand von Strömungsbildern hat die Wissenschaft der Strömungslehre erkannt, dass die Teilchen kurz vorher und unmittelbar nach der engsten Stelle ihre Richtung ändern. An der engsten Stelle selbst müssen die Wasserteilchen aber auch am schnellsten fließen. Durch den verengten Rohrquerschnitt muss pro Sekunde die gleiche Wassermenge hindurch, wie bei dem weiten Rohrquerschnitt. Diesen Vorgang kann man auch bei einer Stromschnelle an einem Fluss beobachten. Die Stromlinien geben an, wie sich der Betrag der Geschwindigkeit der Strömung ändert. Je enger die Stromlinien zusammenrücken, umso größer wird an der betreffenden Stelle die Geschwindigkeit. Die Druckverhältnisse bei Rohren mit unterschiedlichen Durchmessern kann man mit einfachen Experimenten erforschen. Ein Fön bläst Luft durch eine weite Röhre. Die angeschlossenen Wassermanometer zeigen keine Unterschiede, da die Luftteilchen mit konstanter Geschwindigkeit durch die Röhre fließen und weder beschleunigt noch verzögert werden. Die Reibung an der inneren Rohrwand ist für das Experiment unbedeutend.
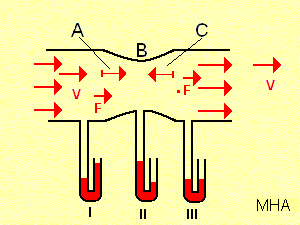
Wird bei diesem Experiment ein Rohr mit einer Verengung verwendet, zeigt Manometer II an der Verengung „B“ bei der schneller strömenden Luft einen Unterdruck an. Durch die Verengung werden die Luftteilchen bei „A“ auf eine größere Geschwindigkeit beschleunigt. Hierfür braucht man eine nach rechts gerichtete Kraft „F“ und der Druck P I ist deshalb größer als P II . Bei C werden die Teilchen wieder verzögert da der Querschnitt zunimmt und man braucht einer der Strömung entgegengerichtete Kraft. –F. Der Druck an Manometer II ist kleiner als an Manometer III, da die Luft in der weiten Röhre frei ausströmen kann. Manometer III zeigt den äußeren Luftdruck an. Dadurch ist der Druck an Manometer II kleiner als der äußere Luftdruck.
Das Experiment zeigt also, werden Teilchen in Strömungsrichtung beschleunigt, so nimmt der Druck ab, werden die Teilchen verzögert, so steigt er. Mit wachsender Stromliniendichte nimmt entlang der Stromlinie der Druck ab, mit abnehmender Stromlinie dagegen zu.
Praktische Anwendungen der Strömungslehre
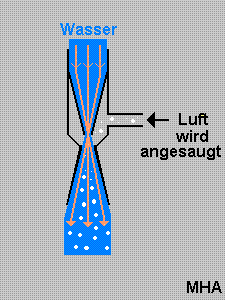
Bei einer Wasserstrahlpumpe wird der Querschnitt des aus einer engen Düse sehr schnell strömenden Wasserstrahls auf ein Vielfaches erweitert bis er an der freien Luft auf Atmosphärendruck kommt. An der engen Stelle bildet sich ein starker Unterdruck aus. Mit dem Unterdruck einer Wasserstrahlpumpe wurden früher in Kellern tiefer gelegene Wasserschächte nach einem starken Regenfall leer gepumpt. Die elektrischen Wasserpumpen die man heutzutage in Baumärkten kaufen kann, gab es früher nicht. Dafür braucht die Wasserstrahlpumpe keine elektrische Antriebsenergie.
Wenn der Wind über die Wasseroberfläche gleitet, werden an einer zufälligen Erhebung der Grenzflächen, die darüber liegenden Stromlinien zusammengedrängt, und es entsteht ein Unterdruck. Das Wasser wird stärker angehoben; es entsteht ein Wellenberg. Im Wellental haben die Stromlinien dagegen einen größeren Abstand.
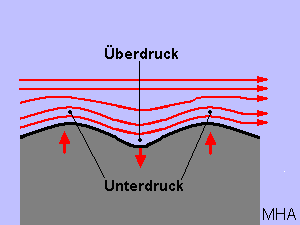
Der somit entstehende überdruck vertieft das Tal noch mehr. Diese Erscheinung tritt auch bei einer Fahne auf, wenn der Wind entlang dem Fahnentuch streicht. Die Fahne flattert im Wind.
Wenn zwei Schiffe nahe beisammen fahren, werden durch die zusammengedrängten Stromlinien die Schiffe zueinander gezogen.
Ein wichtiges Kapitel bildet die Strömungslehre in der Luftfahrt.
